国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 8 医药医疗器械行业报告
在现行仿制药定价机制中,医保对医生处方监督较弱,“回扣-药价-医保支 出”容易形成正循环,导致医保支出压力增大; 在此背景下,医生(医院)倾向于选择药价更高的药品,这是专利过期原研 药享受“超国民待遇”的主要原因之一,造成医保资金浪费; 仿制药企业聚焦销售环节,药价当中包含了大量的营销费用,而这些营销费 用需要患者和医保买单。原研药专利过期后在国内仍可以保持较大销售规模; 原研药定价远高于仿制药; 以氯吡格雷为例,2012年赛诺菲原研药专利过期后全球销售额断崖式 下降,而国内销售规模仍缓慢增长(首仿信立泰2001年即上市); 推动仿制药进口替代将节省大量医保资金。美国仿制药市场集中度高,迭代速度快:2018前11个月,美国仿制 药市场中Top10占比52.3%,Top20占比高达72.7%。2017年仿制药 Top100中有75个是10年内获批或有新剂型上市。 我国仿制药行业集中度低,批文扎堆严重:2018年我国共有医药 企业4441家,远多于美国等发达国家,产能过剩。样本医院市场 Top10企业销售额占比仅21.5%,若剔除进口专利药,则比例更低。 以首批289品种为例,批文数合计高达17740个,其中复方磺胺甲恶 唑片批文数量达到895个。此前审批标准低导致仿制药批文扎堆, 质量和疗效参差不齐,进而降低医保资金使用效率。
2016年国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》(国办发8号),规定化药新注册分类之前上市的仿制药需进行 一致性评价,其中2007年10月前上市的基药口服固体制剂需在2018年底前完成一致性评价;其余口服固体制剂在首家通过后3年内完成。 2018年CFDA发布《关于仿制药质量和疗效一致性评价有关事项的公告》,除基药品种不设评价时限外,其他化药新注册分类实施前上市的 仿制药均需在首家通过后的3年内完成一致性评价,逾期不予再注册。 一致性评价进展:截至2019年10月29日,CDE承办的一致性评价受理号已达1536个,共计425个品种,涉及443家药企。其中通过和视同 通过一致性评价品种的受理号为377个,通过受理号283个,113个品种;视同通过94个受理号,48个品种。“289品种”仅153个受理号, 59个品种通过一致性评价。 注射剂一致性评价正式开启,已有部分企业抢跑:2019年10月15日国家药监局发布化药药品注射剂一致性评价的技术要求和申报资料要 求征求意见稿,预示着注射剂一致性评价正式拉开帷幕。但在此之前已有部分企业抢跑,1536个受理号中注射剂有462个,对应127个品 种,涉及104家药企。

标签: 医药医疗器械行业报告
相关文章
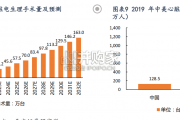
国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 8 医药医疗器械行业报告
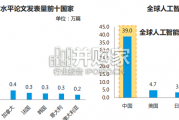
近年来,国内关于人工智能领域的研究十分密集,发文量激增。目前,中国不论在高水平论文还是专利申请数量上都位居世界前列,视觉、语 音、自然语言处理等基础智...
2024-03-07 26 医药医疗器械行业报告

RSV疫苗上市后表现亮眼。据GSK的财报,AREXVY上市后首个季度2023Q3的销售额达7.09亿英镑(约8.5亿美元)全年销售额达12.38亿英镑...
2024-03-05 22 医药医疗器械行业报告
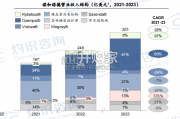
口服胰岛素可更好地模拟人体内胰岛素自然 生理分泌。 正常情况下,胰岛素由胰岛 β 细胞分泌, 经门静脉直接进入肝脏,人体分泌的胰 岛素80%进入肝脏与...
2024-03-04 29 医药医疗器械行业报告
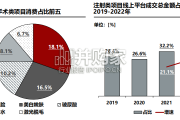
根据2022年新氧医美行业白皮书,2022年非手术类项目消费占比前五的分别是除皱瘦脸、美白嫩肤、玻尿酸、保湿补水和激光脱毛,其中除皱瘦脸和美白嫩肤项目...
2024-03-03 41 医药医疗器械行业报告
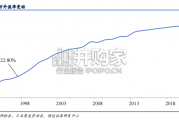
1978 年前,我国医院的所有投资和开销都来自于政府财政,医院主要专注于医疗服务。1978 年改革开放后,国 家财政拨款仅提供医院开支的 10%左右,...
2024-03-02 39 医药医疗器械行业报告
最新留言