国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 17 医药医疗器械行业报告
CDE 新受理的一致性评价申请多为首次申请或暂无企业通过的大品种。 5 月 20 日-7 月 14 日的 8 周时间里,CDE 共受理 161 项一致性评价申 请,涉及 103 个品种(以通用名+剂型计),其中 35 个(36.0%)是受理 时同一通用名+剂型下暂无企业申请的品种;74 个(71.8%)是受理时同 一通用名+剂型下暂无企业通过评价的品种。而且,这两项比例近来均有 所提升,反映出企业在立项时可能会有意选择一致性评价格局较好的品 种,避免“扎堆”竞争。
若以通用名+剂型计,这 103 个品种中,共有 51 个品种(49.5%)的 2018 年 PDB 销售额居于前 500 名,20 个品种(19.4%)的 2018 年 PDB 销售 额居于前 100 名;足见市场空间的大小也是立项时的重要考量之一。鉴于企业存量销售大小+品种对应市场规模+一致性评价竞争格局已成 为带量采购大背景下决定仿制药品种格局的关键因素,而且多数规模较 大的口服制剂已有较多企业申报甚至通过,注射剂品种的一致性评价可 能成为未来一段时间仿制药企业竞争的新战场。 以 2018 年 PDB 销售额前 100 的品种为例,其中共包括 77 个注射剂和 20 个口服固体制剂(片剂+胶囊剂+软胶囊剂)。77 个注射剂品种中,共 有 37 个(48.1%)已有企业申请一致性评价,6 个(7.8%)已有企业通 过一致性评价;20 个口服固体制剂中,共有 16 个(80.0%)已有企业申 请一致性评价,13 个(65.0%)已有企业通过一致性评价。可见与口服 固体制剂相比,注射剂品种的市场空间相对较大、一致性评价竞争尚处 于相对早期,预计通过评价后的竞争也较为缓和,争抢先机的风险收益 比较高。
注射剂再评价最早于 2017 年 5 月提出,当时 NMPA(原 CFDA)发布 《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关 政策(征求意见稿)[2017 年第 54 号],提到:力争用 5 至 10 年左右时 间基本完成已上市注射剂再评价工作。通过再评价的,享受化学仿制药 口服固体制剂质量和疗效一致性评价的相关政策。2017 年 10 月,中共 中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品 医疗器械创新的意见》(两办三十六条),再次强调:对已上市药品注射 剂进行再评价,力争用 5 至 10 年左右时间基本完成。 2017 年 12 月 22 日,CDE 发布关于公开征求《已上市化学仿制药(注射 剂)一致性评价技术要求》,从参评范围、参比制剂、处方工艺、原辅包 材、质量研究与控制、稳定性等多个方面细化已上市化学仿制药注射剂 一致性评价的技术要求。2019 年 3 月 28 日,CDE 发布《化学仿制药参 比制剂目录(第二十一批)》,首次发布 242 个注射剂参比制剂;2019 年 6 月 3 日,CDE 再次发布 229 个注射剂参比制剂。随着政策的不断完善, 注射剂一致性评价山雨欲来。

标签: 医药医疗器械行业报告
相关文章
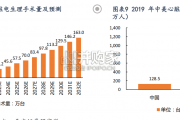
国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 17 医药医疗器械行业报告
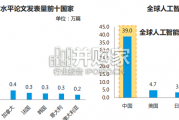
近年来,国内关于人工智能领域的研究十分密集,发文量激增。目前,中国不论在高水平论文还是专利申请数量上都位居世界前列,视觉、语 音、自然语言处理等基础智...
2024-03-07 31 医药医疗器械行业报告

RSV疫苗上市后表现亮眼。据GSK的财报,AREXVY上市后首个季度2023Q3的销售额达7.09亿英镑(约8.5亿美元)全年销售额达12.38亿英镑...
2024-03-05 22 医药医疗器械行业报告
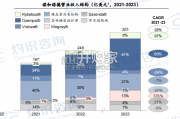
口服胰岛素可更好地模拟人体内胰岛素自然 生理分泌。 正常情况下,胰岛素由胰岛 β 细胞分泌, 经门静脉直接进入肝脏,人体分泌的胰 岛素80%进入肝脏与...
2024-03-04 30 医药医疗器械行业报告
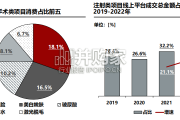
根据2022年新氧医美行业白皮书,2022年非手术类项目消费占比前五的分别是除皱瘦脸、美白嫩肤、玻尿酸、保湿补水和激光脱毛,其中除皱瘦脸和美白嫩肤项目...
2024-03-03 42 医药医疗器械行业报告
1978 年前,我国医院的所有投资和开销都来自于政府财政,医院主要专注于医疗服务。1978 年改革开放后,国 家财政拨款仅提供医院开支的 10%左右,...
2024-03-02 39 医药医疗器械行业报告
最新留言