国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 7 医药医疗器械行业报告
临床研究通过对新药进行广泛的人体试验,评估其对疾病治疗的有效性以 及对人体的安全影响。候选药物临床前研究完成并经临床试验申请批准(IND) 后即可进行临床试验。临床试验按阶段主要分为 I-IV 期,其中 I、II、III 期在 新药在批准上市前进行,而 IV 期临床试验通常在新药注册申请(NDA)完成, 药品上市后进行。 不同临床阶段试验标准和受试人群数量存在较大差异。IND 审核主要关注 候选药物化学结构及其作用机理、副作用、生产工艺和稳定性等。临床 I 期通 过试验,评估候选药物在人体的药理学及安全性。这一阶段通常需要 20-30 例 受试者,规模较小。到临床 II 期验证药物治疗作用和安全性阶段,受试人群增 加到几十至几百人不等,规模扩大,对研发机构临床招募能力提出较高要求。 临床 III 期阶段,主要关注药物用法用量及风险收益比,这一阶段临床受试人 群扩展到几百到数千人。完成临床 III 期后即进入 NDA 阶段,药品上市后仍会 进行临床 IV 期考察在广泛使用条件下的药物疗效和不良反应。
横向来看,临床 CRO 较临床前 CRO 有更为明显的人员规模效应。临床前 CRO 企业更多的是依赖于企业建立的技术平台数量,每个人可参与的环节有 限,因而临床前 CRO 人均创收及人均创造净利润与企业规模相关性较弱。例 如临床前 CRO 领域龙头企业药明康德,人员规模在 2 万人以上,为康龙化成 规模的 3 倍以上,但人均创收和人均创利甚至略低于康龙化成。而对于临床 CRO 企业,企业规模越大,每个人可参与的外包服务环节以及临床中心实验 室越多,单项目成本相应下降,从而形成项目数量和人员投入的正向循环,企 业规模效应凸显。以同为临床 CRO 的博济医药和泰格医药为例,泰格医药人 员数量远高于博济医药,相应的,泰格医药人均创收和人均创利分别为博济医 药的 10 倍。
CMO/CDMO 按阶段可分为实验室(临床前)和工厂(商业化)两大阶段。 药企把生产工艺优化及商业化大规模生产交给 CMO/CDMO 企业后,集中资源 与精力在研发环节,提升药物研发、生产整体成功率和效率。其中,CMO (Contract Manufacture Organization)为药企提供产品研发阶段定制化的原料 药、中间体、制剂等服务,提高新药生产效率。CDMO(Contract Development Manufacture Organization)在 CMO 基础上为药企优化技术路线。CMO/CDMO 按进程分为实验室和工厂扩产阶段,不同生产环节除产出药品外,还会设置不 同的工艺改进、制剂生产优化目标。

标签: 医药医疗器械行业报告
相关文章
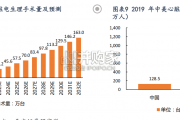
国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 7 医药医疗器械行业报告
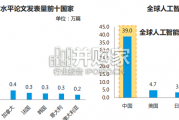
近年来,国内关于人工智能领域的研究十分密集,发文量激增。目前,中国不论在高水平论文还是专利申请数量上都位居世界前列,视觉、语 音、自然语言处理等基础智...
2024-03-07 25 医药医疗器械行业报告

RSV疫苗上市后表现亮眼。据GSK的财报,AREXVY上市后首个季度2023Q3的销售额达7.09亿英镑(约8.5亿美元)全年销售额达12.38亿英镑...
2024-03-05 22 医药医疗器械行业报告
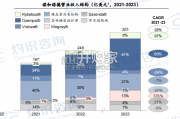
口服胰岛素可更好地模拟人体内胰岛素自然 生理分泌。 正常情况下,胰岛素由胰岛 β 细胞分泌, 经门静脉直接进入肝脏,人体分泌的胰 岛素80%进入肝脏与...
2024-03-04 29 医药医疗器械行业报告
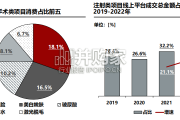
根据2022年新氧医美行业白皮书,2022年非手术类项目消费占比前五的分别是除皱瘦脸、美白嫩肤、玻尿酸、保湿补水和激光脱毛,其中除皱瘦脸和美白嫩肤项目...
2024-03-03 41 医药医疗器械行业报告
1978 年前,我国医院的所有投资和开销都来自于政府财政,医院主要专注于医疗服务。1978 年改革开放后,国 家财政拨款仅提供医院开支的 10%左右,...
2024-03-02 39 医药医疗器械行业报告
最新留言